受託研究管理室
受託研究管理室
患者さまへ
■治験ってなあに?
新しい「お薬」を開発するには、患者さんのご理解とご協力の元、実際に使っていただき、有効性と安全性を調べることが必要です。もしも、人での効き目や副作用を調べずに、「お薬」として広く使われるようなことになれば、病気を治せないばかりか、多くの患者さんに思わぬ副作用を起こすことにもなりかねません。このように健康な人や病気の人に試験的に使用していただいて調べることを「臨床試験」と言います。その中で国(厚生労働省)から「お薬」として認めてもらうために行う臨床試験のことを、特に「治験」と呼んでいます。今、私たちが病気やけがの治療に使っているお薬は、多くの患者さんのボランティアによる「治験」を経て誕生したものなのです。
新しいお薬の開発によって、それまで治らなかった病気が治り、手術をしなくてもすむようになりました。しかし、全ての病気が治せるようになったわけではありません。今でも健康や生命を脅かす病気があり、それらに対して有効なお薬の開発を待ち望んでいる患者さんが数多くおられます。そのため、効き目があって副作用の少ない新しいお薬の開発が世界中で続けられています。これらの新しいお薬もまた、あなたの参加される治験から生まれ、未来へと受け継がれていきます。
■治験コーディネーター(CRC)とは?
治験コディネーター(CRC:clinical research coordinator)は、臨床試験(治験)における医師と患者さま、治験の依頼者との橋渡しとして、病院の他のスタッフと連携をとりながら、治験が適正かつ円滑に実施できるように調整するために生まれた職種です。
■治験Q&A
Q. 主治医から治験に参加するように頼まれたら?
A:治験を開始する前に、主治医、治験コーディネーターから、治験の目的、予測される効果、治療方法、起こる恐れのある副作用などを詳しく説明します。そこで十分に説明を受け、よく理解したうえで、治験への参加は患者さま本人の自由な意志で参加するか否かを決めてください。家に帰って、家族と相談してから決めていただくこともできます。
Q. 誰でも治験に参加できるの?
A:治験に参加できる患者さまの基準が厳密に決められているため、誰もが参加できるわけではありません。診察や検査の結果、担当医師の判断により参加できないこともあります。
Q. 治験薬は安全?
A:治験は安全性の確保と人権保護のために法令化された治験の実施の基準(GCP)に従って計画、実施されています。治験は安全を優先し、もし副作用が発現した場合は、ただちに適切な処置が行えるよう体制を整えておくことになっています。また、病院内には受託研究審査委員会が設置され、治験を引き受けるかを検討し、引き受けた治験は定期的に安全性をチェックしています。治験に至るまで、生体への安全性を確認してから、治験薬を実際患者さまに使っていただくようになりますが、健康状態や体質により予測できない副作用が発現する可能性は否定できません。
Q. 治験に参加するメリット(利点)は?
A:治験に参加し治験薬を使用することは、まだ未発売の新薬を使用できる機会を得ることになります。特に、他に治療法がない場合は、治験薬がその病気の治療薬になることもあります。
治験に参加することは新薬誕生のための創薬・育薬ボランティアとして、社会の貢献になり、次世代の人々の健康に貢献できると言えます。また、治験中は計画書にプログラムされている定期的な検査を受けることができ、経過についての詳しい説明を受けることができます。
Q. 治験に参加するデメリット(不利益)は?
A:治験は計画書に基づいて厳密に行われますので、スケジュールや注意事項を厳密に守っていただくようになります。患者さまにより異なりますが、通院や検査に時間がかかる場合もあります。また、治験薬が患者さまによっては効果が得られなかったり、予期しない副作用が発現する可能性もあることなどです。これらのことは担当医師から説明がありますので、了解の上で参加していただくことになります。
Q. 治験に参加すると費用はかかるの?
A:治験に参加している期間の検査費や治験薬、また一部のお薬の費用は製薬会社が負担しますので、これらの費用を差し引いた費用のうち、保険で支払われる分を差し引いた金額を患者さまにご負担いただきます。治験に参加すると、検査・診察のため来院する回数が通常よりも多くなることがあるため、治験に参加される方の通院などの負担を少しでも軽減する目的で「負担軽減費」が支払われます。初診料や治験終了後の診察費などについては通常通りの負担となります。
Q. 治験を始めたら途中でやめられるの?
A:治験への参加は患者さまの自由意思ですので、いつでもやめることができます。やめた場合でも、患者さまにとって不利益となる扱いを受けることはありません。ただし、自己判断でやめてしまうと体に悪い影響が出る場合もありますので、必ず事前に担当医師または治験コーディネーターにご相談ください。
Q. プライバシーは守られるの?
A:治験に限らず、患者さまのプライバシーや人権保護は国の法律で守られており、個人情報が外部に漏れることはありません。更に、治験においては治験の実施の基準(GCP)によっても治験に参加された方のプライバシーや人権を守ることが定められています。
■現在募集中の治験
詳しいことをお知りになりたい方は、お気軽に受託研究管理室へお問い合わせ下さい。
TEL0248-75-2131(代表)
新しい「お薬」を開発するには、患者さんのご理解とご協力の元、実際に使っていただき、有効性と安全性を調べることが必要です。もしも、人での効き目や副作用を調べずに、「お薬」として広く使われるようなことになれば、病気を治せないばかりか、多くの患者さんに思わぬ副作用を起こすことにもなりかねません。このように健康な人や病気の人に試験的に使用していただいて調べることを「臨床試験」と言います。その中で国(厚生労働省)から「お薬」として認めてもらうために行う臨床試験のことを、特に「治験」と呼んでいます。今、私たちが病気やけがの治療に使っているお薬は、多くの患者さんのボランティアによる「治験」を経て誕生したものなのです。
新しいお薬の開発によって、それまで治らなかった病気が治り、手術をしなくてもすむようになりました。しかし、全ての病気が治せるようになったわけではありません。今でも健康や生命を脅かす病気があり、それらに対して有効なお薬の開発を待ち望んでいる患者さんが数多くおられます。そのため、効き目があって副作用の少ない新しいお薬の開発が世界中で続けられています。これらの新しいお薬もまた、あなたの参加される治験から生まれ、未来へと受け継がれていきます。
■治験コーディネーター(CRC)とは?
治験コディネーター(CRC:clinical research coordinator)は、臨床試験(治験)における医師と患者さま、治験の依頼者との橋渡しとして、病院の他のスタッフと連携をとりながら、治験が適正かつ円滑に実施できるように調整するために生まれた職種です。
■治験Q&A
Q. 主治医から治験に参加するように頼まれたら?
A:治験を開始する前に、主治医、治験コーディネーターから、治験の目的、予測される効果、治療方法、起こる恐れのある副作用などを詳しく説明します。そこで十分に説明を受け、よく理解したうえで、治験への参加は患者さま本人の自由な意志で参加するか否かを決めてください。家に帰って、家族と相談してから決めていただくこともできます。
Q. 誰でも治験に参加できるの?
A:治験に参加できる患者さまの基準が厳密に決められているため、誰もが参加できるわけではありません。診察や検査の結果、担当医師の判断により参加できないこともあります。
Q. 治験薬は安全?
A:治験は安全性の確保と人権保護のために法令化された治験の実施の基準(GCP)に従って計画、実施されています。治験は安全を優先し、もし副作用が発現した場合は、ただちに適切な処置が行えるよう体制を整えておくことになっています。また、病院内には受託研究審査委員会が設置され、治験を引き受けるかを検討し、引き受けた治験は定期的に安全性をチェックしています。治験に至るまで、生体への安全性を確認してから、治験薬を実際患者さまに使っていただくようになりますが、健康状態や体質により予測できない副作用が発現する可能性は否定できません。
Q. 治験に参加するメリット(利点)は?
A:治験に参加し治験薬を使用することは、まだ未発売の新薬を使用できる機会を得ることになります。特に、他に治療法がない場合は、治験薬がその病気の治療薬になることもあります。
治験に参加することは新薬誕生のための創薬・育薬ボランティアとして、社会の貢献になり、次世代の人々の健康に貢献できると言えます。また、治験中は計画書にプログラムされている定期的な検査を受けることができ、経過についての詳しい説明を受けることができます。
Q. 治験に参加するデメリット(不利益)は?
A:治験は計画書に基づいて厳密に行われますので、スケジュールや注意事項を厳密に守っていただくようになります。患者さまにより異なりますが、通院や検査に時間がかかる場合もあります。また、治験薬が患者さまによっては効果が得られなかったり、予期しない副作用が発現する可能性もあることなどです。これらのことは担当医師から説明がありますので、了解の上で参加していただくことになります。
Q. 治験に参加すると費用はかかるの?
A:治験に参加している期間の検査費や治験薬、また一部のお薬の費用は製薬会社が負担しますので、これらの費用を差し引いた費用のうち、保険で支払われる分を差し引いた金額を患者さまにご負担いただきます。治験に参加すると、検査・診察のため来院する回数が通常よりも多くなることがあるため、治験に参加される方の通院などの負担を少しでも軽減する目的で「負担軽減費」が支払われます。初診料や治験終了後の診察費などについては通常通りの負担となります。
Q. 治験を始めたら途中でやめられるの?
A:治験への参加は患者さまの自由意思ですので、いつでもやめることができます。やめた場合でも、患者さまにとって不利益となる扱いを受けることはありません。ただし、自己判断でやめてしまうと体に悪い影響が出る場合もありますので、必ず事前に担当医師または治験コーディネーターにご相談ください。
Q. プライバシーは守られるの?
A:治験に限らず、患者さまのプライバシーや人権保護は国の法律で守られており、個人情報が外部に漏れることはありません。更に、治験においては治験の実施の基準(GCP)によっても治験に参加された方のプライバシーや人権を守ることが定められています。
■現在募集中の治験
詳しいことをお知りになりたい方は、お気軽に受託研究管理室へお問い合わせ下さい。
TEL0248-75-2131(代表)
治験依頼者へ
■規程・手順書など
受託研究取扱規程(PDF形式116KB)
受託研究管理室規程(PDF形式80KB)
受託研究審査委員会業務手順書(PDF形式144KB)
迅速審査に関する手順書(PDF形式73KB)
受託研究に係わる業務手順書(PDF形式183KB)
モニタリング受入れ業務手順書(PDF形式76KB)
監査受入業務手順書(PDF形式74KB)
医薬品使用成績調査、特定使用成績調査及び副作用・感染症報告の受託研究の実施に関する標準業務手順書(PDF形式103KB)
規程・手順書一括ダウンロード(PDF形式1257KB)
■治験等統一書式
治験等書式一覧(一括ダウンロードword圧縮ファイル)
■使用・特定・副作用・感染症書式
使用成績調査等書式一覧(一括ダウンロードword圧縮ファイル)
■受託研究審査委員会名簿
独立行政法人国立病院機構 福島病院 (令和7年4月1日現在)
■IRB議事要旨
●令和7年度 第1回受託研究審査委員会 (IRB)議事要旨(PDF601KB)
受託研究審査委員会は、原則として毎月第1水曜日に開催予定です。
なお、開催予定日は変更になる場合がございますので、詳しくは当院事務局までお問い合わせください。
■検査基準値一覧
●検査基準値一覧(PDF94KB)
■治験書式の取扱いについて
●治験書式の取扱いについて(PDF266KB)
■同意説明書ひな型
同意説明書ひな型(word形式203KB)
同意説明書ひな型(PDF形式252KB)
■治験等実績一覧
現在実績については公表しておりません。
受託研究取扱規程(PDF形式116KB)
受託研究管理室規程(PDF形式80KB)
受託研究審査委員会業務手順書(PDF形式144KB)
迅速審査に関する手順書(PDF形式73KB)
受託研究に係わる業務手順書(PDF形式183KB)
モニタリング受入れ業務手順書(PDF形式76KB)
監査受入業務手順書(PDF形式74KB)
医薬品使用成績調査、特定使用成績調査及び副作用・感染症報告の受託研究の実施に関する標準業務手順書(PDF形式103KB)
規程・手順書一括ダウンロード(PDF形式1257KB)
■治験等統一書式
治験等書式一覧(一括ダウンロードword圧縮ファイル)
■使用・特定・副作用・感染症書式
使用成績調査等書式一覧(一括ダウンロードword圧縮ファイル)
■受託研究審査委員会名簿
| 氏 名 | 職業及び所属 | 委員区分 | |
| 委員長 | 石 井 勉 | 副院長 | |
| 委 員 | 大 橋 隆 史 | 須賀川支援学校校長 | 外部委員 |
| 鈴 木 敬 雄 | 薬剤科長 | ||
| 三 浦 崇 子 | 副看護部長 | ||
| 工 藤 一 光 | 企画課長 | 非専門 | |
| 太 田 紀 彦 | 経営企画室長 | 非専門 |
■IRB議事要旨
●令和7年度 第1回受託研究審査委員会 (IRB)議事要旨(PDF601KB)
受託研究審査委員会は、原則として毎月第1水曜日に開催予定です。
なお、開催予定日は変更になる場合がございますので、詳しくは当院事務局までお問い合わせください。
■検査基準値一覧
●検査基準値一覧(PDF94KB)
■治験書式の取扱いについて
●治験書式の取扱いについて(PDF266KB)
■同意説明書ひな型
同意説明書ひな型(word形式203KB)
同意説明書ひな型(PDF形式252KB)
■治験等実績一覧
現在実績については公表しておりません。
受託研究管理室
■組織図
●組織図(PDF47KB)
■スタッフ
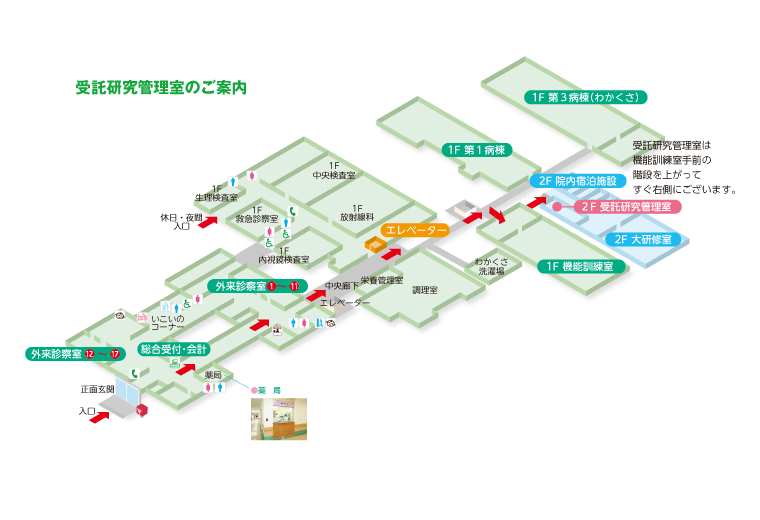
■案内図
●組織図(PDF47KB)
■スタッフ
| 管理室長 | 石 井 勉 | 副院長 |
| 副管理室長 | 鈴 木 敬 雄 | 薬剤科長 |
| 治験薬管理者 | 鈴 木 敬 雄 | 薬剤科長 |
| 事務局部門 事務局長 | 鈴 木 敬 雄 | 薬剤科長 |
| 事務局員 | 志 賀 洋 介 | 調剤主任 |
| 雫 石 哲 也 | 医事専門職 | |
| 齊 藤 直 美 | 契約係長 | |
| CRC部門 | 志 賀 洋 介 | 調剤主任 |
| 石 栗 広 志 | 看護師長 |
■案内図




